Оливково-зеленый цвет и сочетание с ним
Оливково-зеленый цвет — сложный, мягкий оттенок зелени. Он сочетается с такими же приглушенными оттенками в одежде и интерьере.
Глубокий теплый оливково-зеленый цвет косвенно относится к оттенкам хаки. Изящный и тонкий оттенок зеленого хорошо передает шик, как глянцевый, так и бархатистый.
Это сложный тон. Он состоит из зеленого с преобладанием желтого с небольшой примесью красного цвета. Так же его можно представить как зеленый с примесью коричневого. Отсюда берут свое начало и его свойства: роскоши и зажиточности.
Зеленый цвет, как и коричневый – приземленные оттенки, стремящиеся к стабильности и процветанию. Если первый включает в себя нотки авантюризма, то второй зрелый, расчетливый и упорный.
В целом, оливково-зеленый – позитивный цвет. Он положительно действует на психику и обладает расслабляющим эффектом.
Оттенки оливково-зеленого
Оливково-зеленые оттенки лежат в теплой гамме и имеют незначительную красную примесь, которая делает тон приближенным к естественной, мягкой палитре природы.
Оливково-зеленый цвет сочетается
— с ореховым цветом (18-1048 TCX)(2) – родственное и контрастное сочетание. Мягкое и гармоничное, где каждый из цветов приумножает качества другого. Контраст подчеркивает форму и определяет зоны влияния.
— с желто-оранжевым цветом (13-0839 TCX)(3) – это контраст и слияние сходных составляющих. Так же это сочетание по яркости. Желтый, в данном случае, уравновешивает пассивность оливково-зеленого цвета.
Дополните это сочетание цветом с глубоким темно-синим оттенком, свежим голубым и цветом слоновой кости.
Оливково-зеленый цвет в одежде
Мягкий и вычурный оттенок не вяжется с повседневной одеждой, зато он тянется к изысканному стилю. Он хорошо сочетается с золотым и порой может выглядеть просто сказочно. Поэтому и использовать его нужно соответственно: длинные и коктейльные платья для значимых торжеств, таких как новый год или званый обед в ресторане. Оливково-зеленый цвет сделает вас неотразимой, загадочной и роскошной женщиной.
Оливково-зеленый цвет сделает вас неотразимой, загадочной и роскошной женщиной.
С другой стороны он подойдет для отдыха и домашней одежды.
Оливково-зеленый цвет в интерьере
Этот оттенок внесет спокойствия и весомости в ваш интерьер. В 2015 году похожий оттенок под названием Жимолость вошел в десятку модных цветов в интерьере. Так что если вы его выберете в качестве элемента дизайна, то сможете приобрести современные вещи этого оттенка.
Оливково-зеленый цвет хорош для спальни, гостиной, столовой, кухни, в меньшей мере для ванны и туалета. Им хорошо оформлять зоны отдыха, как раз такую мы и рассмотрим.
Основой для нее будет мягкая мебель, журнальный столик и тумбочка.
Диван и кресла можно выбрать темно-синего цвета с ворсистой структурой, которая так же будет поддержана в пуфах. Тумбочка и журнальный столик — цвета орех. На тумбочке можно разместить аксессуары в виде горшков, тарелок, ваз и светильников.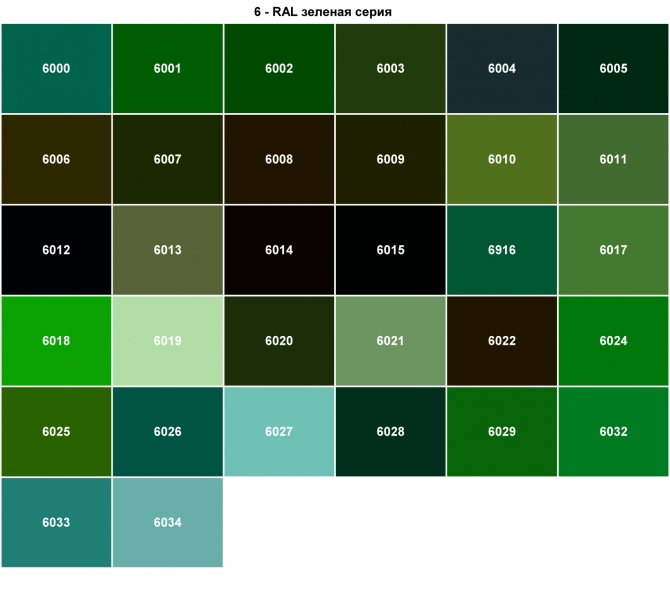
ПОСМОТРЕТЬ СОЧЕТАНИЯ С ПОХОЖИМИ ОТТЕНКАМИ (нажать на цвет)
Зеленый | LOOKCOLOR
Светло-зеленый цвет и его сочетание
Светло-зеленый цвет – оттенок зеленого разбавленный белым. Чаще всего это мягкие тона, естественные и легкие для восприятия
Болотный цвет и его сочетание
Болотный – сложный оттенок. В нем переплетаются коричневые, оливковые, серые и зеленые подтоны, что так же сказывается на его значении.
Цвет лайм и его сочетание
Цвет лайма – это желто-зеленый оттенок, который соответствует мякоти цитрусового фрукта с идентичным названием.
Изумрудно-зеленый цвет и его сочетание
В сочетании преображается любой цвет, не говоря уже о таком глубоком, сочном оттенке, как изумрудно-зеленый.
Фисташковый цвет: сочетание и подбор гардероба
Фисташковый цвет — нежный, юный оттенок зеленого, который создает мягкие и контрастные сочетания. Таблицы, подбор одежды. Фото
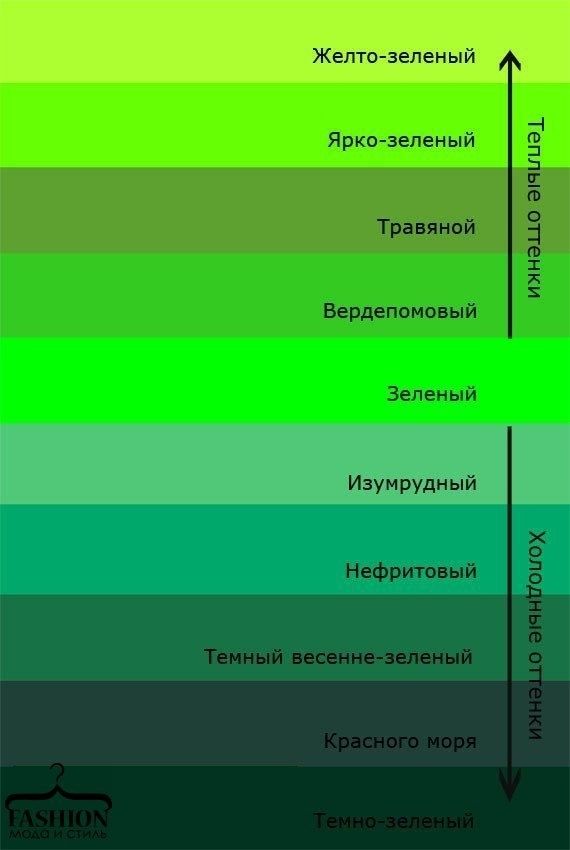
Теплый и холодный зеленый цвет
Если брать классический зеленый цвет, то он состоит из желтого и синего цвета, где желтый – теплый, а синий – холодный цвет. Тона, образованные с преобладанием желтого цвета – считаются теплыми, а цвета, где синий превышает в пропорции желтый – холодными.
Оливково-зеленый цвет и сочетание с ним
Глубокий теплый оливково-зеленый цвет косвенно относится к оттенкам хаки. Изящный и тонкий оттенок зеленого хорошо передает шик, как глянцевый, так и бархатистый.
Изящный и тонкий оттенок зеленого хорошо передает шик, как глянцевый, так и бархатистый.
Коричнево-зеленый цвет и сочетание с ним
Этот цвет можно назвать болотным, хаки или защитным.
У зеленого цвета много оттенков. Их мы видим постоянно, так как наша планета вся покрыта растениями.
Зелено-голубой цвет и сочетание с ним
Зелено-голубой цвет можно представить как светлый тон сине-зеленого оттенка или цвета морской волны, а некоторые называют этот оттенок цветом чистой воды.
Салатовый цвет и сочетание с ним
Это один из оттенков весны: всегда поднимающий настроение, тонизирующий, успокаивающий.
Бело-зеленый цвет и сочетание с ним
Зелено белый оттенок можно найти только на границе белого и зеленого, чаще всего в венчиках белых цветов, в мякоти белых корнеплодов или фруктов.
Темно-зеленый цвет и его сочетание
Это уже не цвет молодой зелени, а заматерелый цвет пышной кроны дерева.
Серо-зеленый цвет и его сочетания
Серо зеленый цвет тумана в летнем лесу. Это очень спокойный, немного отрешенный от действительности оттенок.
Зелено-синий цвет и сочетание с ним
Зелено синий – цвет респектабельности. Свойствами этого цвета являются сдержанность и пафосность.
Зелено-желтый цвет и сочетание с ним
Считается, что желто зеленый цвет связан с раздражи- тельностью и ненадежностью, но почему? Только что распустившаяся зелень под первыми лучами солнца уже обладает вероломством?
Зеленый цвет: значение, применение, сочетание
Прежде всего, это обильная зелень планеты. Зеленый цвет – это сама жизнь. Отсутствие его гнетет, как зима, пустыня, океан и так жизненно необходима весна, оазис, земной берег.
Оттенки зеленого.
 Таблица цветов
Таблица цветов
Зеленые цвета – это 376 тона (в палитре Пантон), светлых, средних и темных, ярких и тусклых, холодных и теплых, с серым, коричневым, желтым, синим оттенками.
24.7: Цвет и цвета комплексов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24356
- OpenStax
- OpenStax
Человеческий глаз воспринимает смесь всех цветов в пропорциях, присутствующих в солнечном свете, как белый свет. Дополнительные цвета, расположенные напротив друг друга на цветовом круге, также используются в цветовом зрении. Глаз воспринимает смесь двух дополнительных цветов в соответствующих пропорциях как белый свет. Точно так же, когда в белом свете отсутствует цвет, глаз видит его дополнение. Например, когда красные фотоны поглощаются белым светом, глаза видят зеленый цвет. Когда фиолетовые фотоны удаляются из белого света, глаза видят лимонно-желтый цвет (рис. \(\PageIndex{1}\)). 9{2+}}\) ионы в растворе поглощают свет в красной области спектра. Свет, который проходит через раствор и выходит с другой стороны, будет иметь в себе все цвета, кроме красного. Мы видим эту смесь длин волн как бледно-голубой (голубой). Диаграмма дает представление о том, что произойдет, если пропустить белый свет через раствор \(\ce{[Cu(NH_3)_4]SO_4}\).
Точно так же, когда в белом свете отсутствует цвет, глаз видит его дополнение. Например, когда красные фотоны поглощаются белым светом, глаза видят зеленый цвет. Когда фиолетовые фотоны удаляются из белого света, глаза видят лимонно-желтый цвет (рис. \(\PageIndex{1}\)). 9{2+}}\) ионы в растворе поглощают свет в красной области спектра. Свет, который проходит через раствор и выходит с другой стороны, будет иметь в себе все цвета, кроме красного. Мы видим эту смесь длин волн как бледно-голубой (голубой). Диаграмма дает представление о том, что произойдет, если пропустить белый свет через раствор \(\ce{[Cu(NH_3)_4]SO_4}\).
Определить, какой цвет вы увидите, непросто, если попытаться сделать это, воображая, что «перепутали» оставшиеся цвета. Вы бы никогда не подумали, что все остальные цвета, кроме красного, будут выглядеть, например, голубыми.
Вспомним, что цвет, который мы наблюдаем, когда смотрим на объект или соединение, обусловлен прошедшим или отраженным светом, а не поглощенным светом, и этот отраженный или прошедший свет дополняет по цвету поглощенный свет. Таким образом, зеленое соединение поглощает свет в красной части видимого спектра и наоборот, на что указывает дополнительный цветовой круг.
Рисунок \(\PageIndex{3}\): Частично заполненные d-орбитали стабильных ионов Cr 3+ (водн.), Fe 3+ (водн.) и Co 2+ (водн.) (слева, в центре и справа соответственно) дают различные цвета. (кредит: Сахар Атва) Яркие цвета, демонстрируемые комплексами переходных металлов, вызваны возбуждением электрона с d-орбитали с более низкой энергией на d-орбиталь с более высокой энергией, что называется переходом d–d (рис. \(\PageIndex{4}\)). Чтобы фотон совершил такой переход, его энергия должна быть равна разности энергий между двумя d-орбиталями, которая зависит от величины Δ или .
\(\PageIndex{4}\)). Чтобы фотон совершил такой переход, его энергия должна быть равна разности энергий между двумя d-орбиталями, которая зависит от величины Δ или .
Пример \(\PageIndex{1}\): Цвета комплексов
Октаэдрический комплекс [Ti(H 2 O) 6 ] 3+ имеет единственный d электрон. Для возбуждения этого электрона из основного состояния t 2 g орбитали на e g орбиталь этот комплекс поглощает свет с длиной волны от 450 до 600 нм. Максимальное поглощение соответствует Δ o и приходится на 499 нм. Рассчитайте значение Δ o в джоулях и предскажите, какого цвета окрасится раствор.
Рассчитайте значение Δ o в джоулях и предскажите, какого цвета окрасится раствор.
Решение
Мы можем преобразовать длину волны в частоту: 9{−19} \,J \end{align*}\]
Поскольку комплекс поглощает от 600 нм (оранжевый) до 450 нм (синий), будут передаваться длины волн индиго, фиолетового и красного, и комплекс будет казаться фиолетовым. .
Примечание: это энергия одного перехода (т.е. в одном комплексе). Если вы хотите рассчитать энергию в Дж/моль, вам нужно умножить ее на число Авогадро (\(N_A\)).
Упражнение \(\PageIndex{1}\)
Комплекс, который кажется зеленым, поглощает фотоны с какими длинами волн?
- Ответить
- красный, 620–800 нм
Цвет зависит от степени окисления
Небольшие изменения в относительных энергиях орбиталей, между которыми перемещаются электроны, могут привести к резкому изменению цвета поглощаемого света. Поэтому цвета координационных соединений зависят от многих факторов. Как показано на рисунке \(\PageIndex{4}\), разные ионы металлов в водной среде могут иметь разные цвета. Кроме того, разные степени окисления одного металла могут давать разные цвета, как показано для комплексов ванадия по ссылке ниже.
Как показано на рисунке \(\PageIndex{4}\), разные ионы металлов в водной среде могут иметь разные цвета. Кроме того, разные степени окисления одного металла могут давать разные цвета, как показано для комплексов ванадия по ссылке ниже.
Посмотрите это видео о восстановлении комплексов ванадия, чтобы увидеть красочный эффект изменения степени окисления.
Цвет зависит от поля лиганда
Конкретные лиганды, координированные с металлическим центром, также влияют на цвет координационных комплексов. Поскольку энергия фотона света обратно пропорциональна его длине волны, цвет комплекса зависит от величины Δ o , которая зависит от структуры комплекса. Например, комплекс [Cr(NH 3 ) 6 ] 3+ имеет лиганды сильного поля и относительно большое Δ o . Следовательно, он поглощает относительно высокоэнергетические фотоны, соответствующие сине-фиолетовому свету, что придает ему желтый цвет. Родственный комплекс с лигандами слабого поля, ион [Cr(H 2 O) 6 ] 3+ , поглощает фотоны с меньшей энергией, соответствующие желто-зеленой части видимого спектра, придавая ему глубокий фиолетовый цвет. Например, комплекс железа(II) [Fe(H 2 O) 6 ]SO 4 выглядит сине-зеленым, поскольку высокоспиновый комплекс поглощает фотоны в красных длинах волн (рис. \(\PageIndex{5}\)). Напротив, низкоспиновый комплекс железа (II) K 4 [Fe (CN) 6 ] выглядит бледно-желтым, потому что он поглощает фиолетовые фотоны с более высокой энергией.
Родственный комплекс с лигандами слабого поля, ион [Cr(H 2 O) 6 ] 3+ , поглощает фотоны с меньшей энергией, соответствующие желто-зеленой части видимого спектра, придавая ему глубокий фиолетовый цвет. Например, комплекс железа(II) [Fe(H 2 O) 6 ]SO 4 выглядит сине-зеленым, поскольку высокоспиновый комплекс поглощает фотоны в красных длинах волн (рис. \(\PageIndex{5}\)). Напротив, низкоспиновый комплекс железа (II) K 4 [Fe (CN) 6 ] выглядит бледно-желтым, потому что он поглощает фиолетовые фотоны с более высокой энергией.
В общем, сильнопольные лиганды вызывают большое расщепление энергий d орбиталей центрального атома металла (большое Δ окт ). Координационные соединения переходных металлов с этими лигандами имеют желтый, оранжевый или красный цвет, потому что они поглощают фиолетовый или синий свет с более высокой энергией. С другой стороны, координационные соединения переходных металлов с лигандами слабого поля часто бывают сине-зелеными, синими или индиго, потому что они поглощают желтый, оранжевый или красный свет с более низкой энергией.
Координационные соединения переходных металлов с этими лигандами имеют желтый, оранжевый или красный цвет, потому что они поглощают фиолетовый или синий свет с более высокой энергией. С другой стороны, координационные соединения переходных металлов с лигандами слабого поля часто бывают сине-зелеными, синими или индиго, потому что они поглощают желтый, оранжевый или красный свет с более низкой энергией.
Лиганды сильного поля вызывают большое расщепление энергий d орбиталей центрального атома металла, а координационные соединения переходных металлов с этими лигандами обычно имеют желтый, оранжевый или красный цвет, поскольку они поглощают фиолетовый или синий свет с более высокой энергией. Координационные соединения переходных металлов с лигандами слабого поля часто бывают сине-зелеными, синими или индиго, потому что они поглощают желтый, оранжевый или красный свет с более низкой энергией.
Пример \(\PageIndex{2}\): сопоставление цветов с полями лигандов 9{3+}}\) дается приравниванием уравнения Планка к параметру расщепления кристаллического поля:
\[E= h \nu= \dfrac{hc}{\lambda} = \Delta_o \label{eq1}\]
Теперь нам нужно получить относительную корреляцию между наблюдаемым цветом (для глаза) и длиной волны поглощаемого света. Из дополнительного цветового круга на рисунке \(\PageIndex{1}\) мы получаем следующие соотношения (расположенные от наибольшей поглощаемой энергии к наименьшей):
Из дополнительного цветового круга на рисунке \(\PageIndex{1}\) мы получаем следующие соотношения (расположенные от наибольшей поглощаемой энергии к наименьшей):
- 400-нм Поглощенный фиолетовый свет → наблюдаемый зелено-желтый
- Синий свет с длиной волны 430 нм поглощается → наблюдается оранжевый
- Синий свет с длиной волны 450 нм поглощается → желтый наблюдается
- 490-нм поглощенный сине-зеленый свет → наблюдаемый красный
- 570 нм Поглощенный желто-зеленый свет → наблюдается фиолетовый
- 580 нм Поглощенный желтый свет → наблюдается темно-синий
- Оранжевый свет с длиной волны 600 нм поглощается → наблюдается синий
- 650 нм Поглощение красного света → наблюдается зеленый
Из четырех возможных цветов, приведенных в задаче (синий, зеленый, желтый и оранжевый), поглощаются соответствующие цвета (600 нм, 650 нм, 450 нм и 430 соответственно). Из уравнения \(\ref{eq1}\) меньшее \(\lambda\) поглощенного света соответствует фотонам с более высокой энергией, поэтому мы должны соотнести четыре длины волны поглощающих фотонов с точки зрения увеличения энергии с наблюдаемым цветом: 9—\).
Координационное соединение иона Cu + имеет конфигурацию d 10 , и все орбитали e g заполнены. Чтобы возбудить электрон на более высокий уровень, такой как орбиталь 4 p , необходимы фотоны очень высокой энергии. Эта энергия соответствует очень коротким длинам волн в ультрафиолетовой области спектра. Видимый свет не поглощается, поэтому глаз не замечает изменений, и соединение кажется белым или бесцветным. Раствор, содержащий [Cu(CN) 2 ] − , например, бесцветен. С другой стороны, октаэдрические комплексы Cu 2+ имеют вакансию на орбиталях e g , и на этот уровень могут возбуждаться электроны. Длина волны (энергия) поглощенного света соответствует видимой части спектра, а комплексы Cu 2+ почти всегда окрашены в синий, сине-зелено-фиолетовый или желтый цвет (рис. \(\PageIndex{6}\) ). Хотя CFT успешно описывает многие свойства координационных комплексов, для полного понимания поведения координационных комплексов необходимы объяснения молекулярных орбиталей (выходящие за рамки вводного объема, представленного здесь).
Драгоценные камни
Рубин — это драгоценный камень от розового до кроваво-красного цвета, состоящий из следовых количеств хрома в минеральном корунде \(Al_2O_3\). Напротив, изумруды окрашены в зеленый цвет из-за следовых количеств хрома в составе Be 9.0035 3 Al 2 Si 6 O 18 Матрица. Теперь мы можем понять, почему изумруды и рубины имеют такие разные цвета, хотя оба содержат Cr 3 + в октаэдрическом окружении, образованном шестью оксидными ионами. Хотя химическая идентичность шести лигандов одинакова в обоих случаях, расстояния Cr–O различны, потому что составы решеток-хозяев различны (Al 2 O 3 в рубинах и Be 3 Al 2 Si 6 O 18 в изумрудах). В рубине расстояния Cr–O относительно малы из-за ограничений основной решетки, что увеличивает взаимодействие d-орбитали–лиганд и делает Δ o относительно большим. Следовательно, рубины поглощают зеленый свет, а проходящий или отраженный свет имеет красный цвет, что придает драгоценному камню его характерный цвет. В изумруде расстояния Cr—O больше из-за относительно больших [Si 6 O 18 ] 12− силикатные кольца; это приводит к уменьшению взаимодействия d-орбиталь-лиганд и меньшему Δ o . Следовательно, изумруды поглощают свет с большей длиной волны (красный), что придает драгоценному камню характерный зеленый цвет. Ясно, что окружение иона переходного металла, определяемое основной решеткой, существенно влияет на спектроскопические свойства иона металла.
В рубине расстояния Cr–O относительно малы из-за ограничений основной решетки, что увеличивает взаимодействие d-орбитали–лиганд и делает Δ o относительно большим. Следовательно, рубины поглощают зеленый свет, а проходящий или отраженный свет имеет красный цвет, что придает драгоценному камню его характерный цвет. В изумруде расстояния Cr—O больше из-за относительно больших [Si 6 O 18 ] 12− силикатные кольца; это приводит к уменьшению взаимодействия d-орбиталь-лиганд и меньшему Δ o . Следовательно, изумруды поглощают свет с большей длиной волны (красный), что придает драгоценному камню характерный зеленый цвет. Ясно, что окружение иона переходного металла, определяемое основной решеткой, существенно влияет на спектроскопические свойства иона металла.

Спектр поглощения рубина показан на рисунке \(\PageIndex{7; слева}\). Количество и положение пиков в спектре определяются электронной структурой соединения, которая в данном случае зависит от идентичности металла и идентичности, количества и геометрии окружающих ионов. Теория кристаллического поля может использоваться для предсказания электронной структуры и, следовательно, спектра поглощения. Если белый свет виден на драгоценном камне, спектр поглощения показывает, какие длины волн света удаляются. В этом случае имеются интенсивные полосы с центрами 414 и 561 нм. Эти длины волн соответствуют синему и желто-зеленому свету соответственно. По большей части эти цвета не присутствуют в свете, попадающем в глаза. Альтернативный способ выразить эту концепцию состоит в том, чтобы признать, что спектр света, достигающего глаза, является произведением спектра падающего света (белого света) и спектр пропускания . Для этого рубина спектр пропускания имеет пик при 481 нм и широкое плато после 620 нм. (Обратите внимание, что существует значительное ослабление света по всему спектру.) Таким образом, только свет с длиной волны около 481 нм (голубой) и более 620 нм (красный) достигает глаза.
(Обратите внимание, что существует значительное ослабление света по всему спектру.) Таким образом, только свет с длиной волны около 481 нм (голубой) и более 620 нм (красный) достигает глаза.
 Данные получены с сервера Caltech Mineral Spectroscopy Server
Данные получены с сервера Caltech Mineral Spectroscopy Server. Резюме
Когда атомы или молекулы поглощают свет на нужной частоте, их электроны возбуждаются на более высокоэнергетические орбитали. Для многих атомов и молекул основных групп поглощенные фотоны находятся в ультрафиолетовой области электромагнитного спектра, которая не может быть обнаружена человеческим глазом. Для координационных соединений разница энергий между d орбиталей часто позволяет поглощать фотоны в видимом диапазоне.
Авторы и ссылки
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2bd…[email protected]).
Проф. Дэвид Блоух (Колледж Дэвидсона)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.

- Теги
- переход d-d
ЦВЕТА СЛОЖНЫХ ИОНОВ МЕТАЛЛОВ На этой странице будет просто рассмотрено происхождение цвета сложных ионов, в частности, почему так много ионов переходных металлов окрашены. Имейте в виду, что это только введение в то, что может перерасти в чрезвычайно сложную тему. Почему некоторые соединения окрашены? Белый свет Вы, конечно, знаете, что если пропустить белый свет через призму, он распадется на все цвета радуги. Видимый свет — это просто небольшая часть электромагнитного спектра, большую часть которого мы не видим: гамма-лучи, рентгеновские лучи, инфракрасное излучение, радиоволны и так далее. Каждый из них имеет определенную длину волны: от 10 -16 метров для гамма-лучей до нескольких сотен метров для радиоволн. На диаграмме показано приближение к спектру видимого света. | ||
Важно: Это не настоящий спектр — это вымышленный рисунок. Цвета являются лишь приблизительными значениями, как и приписанные им длины волн. Любой, кто решит использовать этот спектр в качестве чего-то большего, чем иллюстрация, должен знать, что он не претендует на точность! | ||
Почему раствор сульфата меди(II) синий? Если белый свет (например, обычный солнечный свет) проходит через раствор сульфата меди(II), некоторые длины волн света поглощаются раствором. Ионы меди(II) в растворе поглощают свет в красной области спектра. Свет, который проходит через раствор и выходит с другой стороны, будет иметь в себе все цвета, кроме красного. Мы видим эту смесь длин волн как бледно-голубой (голубой). Диаграмма дает представление о том, что произойдет, если пропустить белый свет через раствор сульфата меди(II). Определить, какой цвет вы увидите, будет непросто, если вы попытаетесь сделать это, вообразив, что «перепутали» оставшиеся цвета. Вы бы никогда не подумали, что все остальные цвета, кроме красного, будут выглядеть, например, голубыми. Иногда то, что вы видите на самом деле, весьма неожиданно. Смешивание различных длин волн света не дает такого же результата, как смешивание красок или других пигментов. Однако иногда можно получить некоторую оценку цвета, который вы увидите, используя идею дополнительных цветов . Дополнительные цвета Если расположить несколько цветов по кругу, получится «цветовой круг». На схеме показан один из возможных вариантов этого. Поиск в интернете выдаст много разных версий! Цвета, расположенные прямо напротив друг друга на цветовом круге, называются дополнительными цветами. Смешивание двух дополнительных цветов света даст вам белый свет. | ||
Осторожно: Это НЕ то же самое, что смешивать цвета краски. Если вы смешаете желтую и синюю краску, вы не получите белую краску. Это сбивает с толку? ДА! | ||
Все это означает, что если определенный цвет поглощается из белого света, то, что ваш глаз определяет, смешивая все другие длины волн света, является его дополнительным цветом. Раствор сульфата меди (II) имеет бледно-голубой (голубой) цвет, потому что он поглощает свет в красной области спектра. Голубой — дополнительный цвет красного. | ||
Примечание: Если вам интересно понять взаимосвязь между поглощаемым и видимым цветом (помимо самого основного описания выше), найдите путь к уроку 2 («Цвет и зрение») раздела «Световые волны и зрение» на Кабинет физики.  Я не даю прямую ссылку на эти страницы, потому что этот сайт все еще развивается, и безопаснее давать ссылку на главную страницу сайта. Это самое понятное объяснение, которое я нашел в Интернете. Я не даю прямую ссылку на эти страницы, потому что этот сайт все еще развивается, и безопаснее давать ссылку на главную страницу сайта. Это самое понятное объяснение, которое я нашел в Интернете. | ||
Происхождение окраски комплексных ионов Переходный металл против комплексных ионов других металлов Что такое переходный металл? Мы часто небрежно говорим о переходных металлах как о тех, которые находятся в середине Периодической таблицы, где заполнены d-орбитали, но на самом деле их следует называть d-блочными элементами, а не переходными элементами (или металлами). | ||
Примечание: Если вы не понимаете заполнение орбиталей в Периодической таблице, то вы должны пройти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
В этой укороченной версии Периодической таблицы показана первая строка блока d, где заполняются 3d-орбитали. Обычное определение переходный металл представляет собой металл, образующий один или несколько стабильных ионов, которые имеют неполностью заполненные d-орбитали . | ||
Примечание: Самое последнее определение IUPAC включает возможность того, что сам элемент также имеет неполные d-орбитали. Это вряд ли будет большой проблемой (на самом деле она возникает только со скандием), но вам будет полезно выучить ту версию, которую хочет ваша программа. Обе версии определения в настоящее время используются в различных учебных программах Великобритании. Если вы готовитесь к экзамену в Великобритании и у вас нет копии программы, перейдите по этой ссылке, чтобы узнать, как ее получить. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | ||
Цинк с электронной структурой [Ar] 3d 10 4s 2 не считается переходным металлом, какое бы определение вы ни использовали. На другом конце ряда скандий ( [Ar] 3d 1 4s 2 ) также не считается переходным металлом. Хотя в металле есть частично заполненный d-уровень, когда он образует свой ион, он теряет все три внешних электрона. Ион Sc 3+ не считается ионом переходного металла, потому что его уровень 3d пуст. Некоторые образцы цветов На диаграммах показаны приблизительные цвета некоторых типичных ионов металлов гексааква с формулой [ M(H 2 О) 6 ] n+ . Заряд этих ионов обычно равен 2+ или 3+. | ||
Примечание: Если вам не нравятся названия комплексных ионов, вам может быть полезно перейти по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Ионы непереходных металлов Все эти ионы бесцветны. Ионы переходных металлов Соответствующие ионы переходных металлов окрашены. Некоторые из них, такие как ион гексааквамарганца (II) (не показан) и ион гексаакваэрона (II), довольно слабо окрашены, но они имеют 90 481 окраску 90 482. Итак. . . что заставляет ионы переходных металлов поглощать длины волн видимого света (вызывая цвет), тогда как ионы непереходных металлов этого не делают? И почему цвет так сильно варьируется от иона к иону? Происхождение окраски комплексных ионов, содержащих переходные металлы Комплексные ионы, содержащие переходные металлы, обычно окрашены, в то время как аналогичные ионы непереходных металлов не окрашены. Это говорит о том, что частично заполненные d-орбитали должны каким-то образом участвовать в формировании цвета. Помните, что переходные металлы определяются как имеющие частично заполненные d-орбитали. Октаэдрические комплексы Для простоты мы рассмотрим октаэдрические комплексы, которые имеют шесть простых лигандов, расположенных вокруг центрального иона металла. Аргумент на самом деле ничем не отличается, если у вас есть мультидентатные лиганды — это просто немного сложнее представить! | ||
Примечание: Если вы не уверены в форме сложных ионов, вам может быть полезно перейти по этой ссылке, прежде чем продолжить. Вам нужно только прочитать начало этой страницы. Если вы не знаете, что такое лиганд, вам следует срочно прочитать введение в комплексные ионы! Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Когда лиганды связываются с ионом переходного металла, возникает отталкивание между электронами в лигандах и электронами на d-орбиталях иона металла. Это повышает энергию d-орбиталей. Однако из-за того, как d-орбитали расположены в пространстве, это не увеличивает все их энергии на одинаковую величину. На схеме показано расположение d-электронов в ионе Cu 2+ до и после связывания с ним шести молекул воды. Всякий раз, когда 6 лигандов располагаются вокруг иона переходного металла, d-орбитали всегда таким образом разделяются на 2 группы — 2 с более высокой энергией, чем остальные 3. Величина энергетической щели между ними (показана синими стрелками на диаграмме) зависит от природы иона переходного металла, степени его окисления (например, 3+ или 2+) и природы лиганды. Когда белый свет проходит через раствор этого иона, часть энергии света используется для продвижения электрона с нижнего набора орбиталей в пространство верхнего набора. Каждой длине волны света соответствует определенная энергия. Красный свет имеет наименьшую энергию в видимой области. Фиолетовый свет обладает наибольшей энергией. Предположим, что энергетическая щель на d-орбиталях комплексного иона соответствует энергии желтого света. Желтый свет будет поглощаться, потому что его энергия будет использована для продвижения электрона. Остаются другие цвета. Ваш глаз увидит проходящий свет как темно-синий, потому что синий является дополнительным цветом к желтому. | ||
Предупреждение: Это серьезное упрощение, но оно подходит для этого уровня (уровень UK A или аналогичный). Например, он не учитывает поглощение, происходящее в широком диапазоне длин волн, а не в одном, или в случаях, когда поглощается более одного цвета из разных частей спектра. Если ваша учебная программа требует, чтобы вы знали о том, как формы d-орбиталей определяют разделение энергий, перейдите по этой ссылке для получения краткого объяснения. | ||
Как насчет комплексных ионов непереходных металлов? Непереходные металлы не имеют частично заполненных d-орбиталей. Видимый свет поглощается только в том случае, если некоторая энергия света используется для продвижения электрона точно через правильную энергетическую щель. Например, хотя скандий является членом d-блока, у его иона (Sc 3+ ) не осталось d-электронов для движения. Это ничем не отличается от иона на основе Mg 2+ или Al 3+ . Комплексы скандия (III) бесцветны, поскольку не поглощают видимый свет. В случае с цинком уровень 3d полностью заполнен — нет ни одной щели, куда мог бы продвинуться электрон. Комплексы цинка также бесцветны. Тетраэдрические комплексы Простые тетраэдрические комплексы имеют четыре лиганда, расположенных вокруг центрального иона металла. Опять же лиганды влияют на энергию d-электронов в ионе металла. На этот раз, конечно, лиганды расположены в пространстве по-другому относительно формы d-орбиталей. В результате, когда d-орбитали разделяются на две группы, три из них имеют большую энергию, а две другие — меньшую энергию (противоположное расположению в октаэдрическом комплексе). Если не считать этого различия в деталях, объяснение происхождения цвета с точки зрения поглощения определенных длин волн света точно такое же, как и для октаэдрических комплексов. Факторы, влияющие на цвет комплексного иона переходного металла В каждом случае мы будем выбирать конкретный ион металла в качестве центра комплекса и изменять другие факторы. Цвет меняется довольно случайным образом от металла к металлу в переходной серии. Природа лиганда Различные лиганды по-разному влияют на энергии d-орбиталей центрального иона. Некоторые лиганды обладают сильными электрическими полями, которые вызывают большую энергетическую щель, когда d-орбитали разделяются на две группы. Другие имеют гораздо более слабые поля, создающие гораздо меньшие промежутки. Помните, что размер зазора определяет, какая длина волны света будет поглощаться. В списке показаны некоторые распространенные лиганды. Чем больше расщепление, тем больше энергии необходимо для продвижения электрона с низшей группы орбиталей на высшие. С точки зрения цвета поглощаемого света большая энергия соответствует более коротким длинам волн. Это означает, что по мере увеличения расщепления поглощенный свет будет смещаться от красного конца спектра к оранжевому, желтому и так далее. В химии меди(II) имеется довольно четкий случай. Если к ионам гексааквамеди(II) в растворе добавить избыток раствора аммиака, бледно-голубой (голубой) цвет сменится на темно-чернило-синий, поскольку некоторые молекулы воды в комплексном ионе заменяются аммиаком. Первый комплекс должен поглощать красный свет, чтобы дать дополнительный голубой цвет. Второй должен поглощать в желтой области, чтобы дать дополнительный цвет темно-синий. Желтый свет имеет более высокую энергию, чем красный свет. Однако увидеть это не всегда так просто! Попытка разобраться, что поглощается, когда у вас есть мутные цвета не на простом цветовом круге дальше по странице, гораздо большая проблема. На диаграммах приведены приблизительные цвета некоторых ионов на основе хрома(III). Очевидно, что смена лиганда меняет цвет, но пытаться объяснить цвета с точки зрения нашей простой теории непросто. | ||
Примечание: Честно говоря, я потратил пару недель, пытаясь найти способ сделать это просто, на основе простого цветового круга, и в конце концов сдался. Жизнь слишком коротка! | ||
Степень окисления металла По мере увеличения степени окисления металла увеличивается и степень расщепления d-орбиталей. Изменения степени окисления, таким образом, изменяют цвет поглощаемого света и, таким образом, цвет света, который вы видите. Возьмем другой пример из химии хрома, включающий только изменение степени окисления (от +2 до +3): Ион 2+ почти такого же цвета, как ион гексааквамеди(II), а ион 3+ имеет трудно поддающийся описанию фиолетово-сине-серый цвет. Координация иона Расщепление больше, если ион октаэдрический, чем если он тетраэдрический, и поэтому цвет будет меняться при изменении координации. К сожалению, я не могу придумать ни одного простого примера, чтобы проиллюстрировать это! Проблема в том, что ион обычно меняет координацию только при смене лиганда, а смена лиганда также меняет цвет. Вы не можете изолировать эффект изменения координации. Например, часто цитируемый случай происходит из химии кобальта (II) с ионами [Co(H 2 O) 6 ] 2+ и [CoCl 4 ] 2- . Разница в цветах будет комбинацией эффекта смены лиганда и изменения количества лигандов. | ||
Примечание: Существует интересный ряд соединений, описываемых как «термохромные». Они меняют цвет при нагревании. Например, [(CH 3 CH 2 ) 2 NH 2 ] 2 CuCl 4 . Он содержит ион тетрахлоркупрата (II) в сочетании с положительным ионом, который по существу представляет собой ион аммония, в котором два атома водорода заменены этильными группами. Это твердое вещество ярко-зеленого цвета на холоде, которое становится ярко-желтым при 43°C. Ярко-зеленое твердое вещество имеет четыре атома хлора, расположенных вокруг центрального иона меди (II) в форме квадрата. У желтого они расположены в виде искаженного тетраэдра. Изменение цвета связано с изменением расположения лигандов. Это ученая степень. Если вы хотите продолжить, вы можете выполнить поиск в Google (включая Google Книги) по запросу термохромный тетрахлорокупрат (II) . | ||
| ||

 Видимый свет имеет длину волны примерно от 400 до 750 нм. (1 нанометр = 10 -9 метров.)
Видимый свет имеет длину волны примерно от 400 до 750 нм. (1 нанометр = 10 -9 метров.)
 Синий и желтый — дополнительные цвета; красный и голубой дополняют друг друга; а также зеленый и пурпурный.
Синий и желтый — дополнительные цвета; красный и голубой дополняют друг друга; а также зеленый и пурпурный.
 В металле имеет полноценный 3д уровень. Когда он образует ион, 4s-электроны теряются — снова остается полностью полный 3d-уровень.
В металле имеет полноценный 3д уровень. Когда он образует ион, 4s-электроны теряются — снова остается полностью полный 3d-уровень. (Извините, я не могу сделать действительно бесцветным!)
(Извините, я не могу сделать действительно бесцветным!)
 Вместо этого он разделяет их на две группы.
Вместо этого он разделяет их на две группы.
 Непереходные металлы не имеют электронных переходов, которые могут поглощать длины волн видимого света.
Непереходные металлы не имеют электронных переходов, которые могут поглощать длины волн видимого света.
 Те, что наверху, производят наименьшее расщепление; те внизу самое большое расщепление.
Те, что наверху, производят наименьшее расщепление; те внизу самое большое расщепление. Вам нужна эта более высокая энергия, потому что аммиак вызывает большее расщепление d-орбиталей, чем вода.
Вам нужна эта более высокая энергия, потому что аммиак вызывает большее расщепление d-орбиталей, чем вода.

